고대 인공지능학과/바이오의공학부 성준경 교수팀
고려대학교(총장 정진택) 인공지능학과/바이오의공학부 성준경 교수(교신저자)와 이화진 박사(제1저자)의 연구 논문이 세계적인 권위의 과학저널 ‘셀 뉴런(Cell Neuron: IF=17.17)’에 미국 현지시간 4월 19일 게재됐다.
게재된 성준경 교수팀의 논문 「Regional Aβ-tau interactions promote onset and acceleration of Alzheimer’s disease tau spreading」은 알츠하이머 치매를 유발하는 베타-아밀로이드(β-amyloid)와 타우(tau) 단백질의 이상 침착 과정을 밝히고, 뇌 영상 분석을 통해 두 단백질 사이의 상호작용이 알츠하이머 질병을 어떻게 진행시키는지 설명할 수 있는 핵심 기전을 최초로 제시했다.
알츠하이머 치매는 베타-아밀로이드 단백질이 대뇌에 이상 침착되면서 시작된다고 잘 알려져 있다. 베타-아밀로이드의 침착은 대뇌 신경세포가 소멸하고 인지기능 저하와 같은 증상이 나타나는 시기보다 10년에서 20년 정도 일찍 발생하기 때문에 조기진단에 매우 중요한 바이오마커로 인식되고 있다. 최근에는 실제 신경세포의 죽음은 독성을 띠는 타우 단백질의 뭉침 현상에 더욱 크게 연관된다는 사실이 알려지면서 베타-아밀로이드와 타우 단백질 간 관계를 밝히기 위한 연구가 많이 진행되고 있다. 하지만, 지금까지 이들 사이의 상호작용을 설명할 수 있는 모델은 없었으며, 타우 단백질의 전파 과정에 베타-아밀로이드가 어떤 역할을 하는지에 대해서는 명확하게 알려진 바가 없었다.
이번에 개발된 아밀로이드-타우 상호작용 모델은 알츠하이머 치매가 처음 시작되는 과정에서 대뇌 특정 영역에 응집된 타우 단백질에 아밀로이드가 원격으로 영향을 주어서 주위 영역으로 전파가 시작되도록 유도한다는 사실을 밝혀냈다.
이뿐만 아니라, 타우 단백질의 응집 현상은 신경망으로 연결된 주위 영역으로 조금씩 전파되는데, 어느 시점을 지나면 대뇌의 대부분 영역으로 슈퍼전파가 일어난다. 본 논문에서는 이러한 타우의 급격한 전파가 발생하는 것이 아밀로이드와 특정 영역에서 직접 만나면서 부스팅되기 때문이라는 것을 새롭게 밝혀냈다.
대뇌의 대부분 영역에 타우 단백질의 슈퍼전파가 일어나면 신경세포가 죽어서 소멸하는 현상을 막을 수가 없게 되어 결국 치매를 되돌리지 못하게 만든다는 측면에서 이 시기를 밝히는 것이 치매 치료에 매우 중요할 것으로 생각되고 있다.
성준경 고려대 교수는 “지금까지 알츠하이머 치매를 치료하기 위해서는 원인 물질인 베타-아밀로이드를 제거하면 된다는 생각에 글로벌 제약회사들이 25년 넘게 50조에 가까운 예산을 들여 치료제를 개발했으나 실패했다”라며 “이번 논문에서는 베타-아밀로이드를 표적으로 하는 치료제라도 타우의 슈퍼전파가 일어나기 전까지만 효능이 있으리라는 것을 세계최초로 밝힌 것”이라고 설명했다.
성교수는 “세계최초로 미국 FDA로부터 조건부 승인을 받은 바이오젠의 알츠하이머 치료제(아두헬름, Aduhelm)와 같이 베타-아밀로이드를 표적으로 하는 약물이 향후 여러 제약회사에서 출시되고 국내에도 들어오게 된다면 이들 약물의 효과를 극대화할 수 있는 환자들이 누구인지 알려줄 수 있는 동반진단 기술이 반드시 필요할 것”이라며 “뇌 영상을 기반으로 개인별 알츠하이머 치료의 골든타임을 알려줄 수 있는 이 기술이 치료제 부작용이나 시기를 놓쳐 안타깝게 치료의 효능을 보지 못하는 환자들을 막을 수 있다는 측면에서 향후 고령화 시대에 치매의 정밀의료를 실현하는 데 도움을 줄 수 있을 것이다”라고 연구 의의를 밝혔다.
이번 연구는 University of California at San Francisco의 William Seeley 교수 연구 팀과 공동으로 수행했으며, 과학기술정보통신부의 ‘중견연구자지원사업’과 ‘인공지능대학원지원사업’ 지원을 받아 수행됐다.
[ 논문 소개 ]
제목 : Regional Aβ-tau interactions promote onset and acceleration of Alzheimer’s disease tau spreading
■ 뇌의 베타-아밀로이드(β-amyloid) 침착 및 타우(tau) 신경섬유 다발(neurofibrillary tangle) 형성은 알츠하이머병에서 볼 수 있는 병리학적 특징이다. 이 중 타우가 쌓인 정도나 퍼진 양상은 증상의 종류나 중증도와 밀접한 관련이 있음이 밝혀졌고, 베타-아밀로이드는 이런 타우의 확산을 유발한다고 여겨져 왔다. 하지만 알츠하이머병 초기에 베타-아밀로이드와 타우가 서로 다른 뇌 영역에서 관찰되는 현상은 이 가설에 의문을 제기해왔고, 타우 전파 현상의 기전을 밝히기 위해 많은 시도가 이루어졌다. 특히 최근에는 타우가 시냅스를 통해 다른 신경세포로 전파된다는 가설이 힘을 얻으면서 뇌 신경망 기반의 모델들이 많이 제안되었다. 그러나 어떻게 멀리 있는 베타-아밀로이드가 초기 타우 병리에 영향을 미쳐서 주변으로 퍼지게 만드는지, 또 후기의 광범위한 타우 전파에 베타-아밀로이드가 어떤 역할을 하는지, 이 두 가지를 모두 설명하지는 못했다.
■ 성준경 교수 연구팀은 타우 전파의 시작과 가속 현상을 모두 설명할 수 있는 두 가지 아밀로이드-타우 상호작용 모델을 제안하였다. 각 상호작용 모델은 두 주요 영역에서 타우 전파가 일어날 때의 아밀로이드-타우 간 분포 양상을 토대로 정의되었는데, 하나는 타우가 쌓이기 시작하는 뇌 영역이고 다른 하나는 타우 슈퍼전파에 가장 큰 역할을 하는 것으로 추정되는 뇌 영역이다. 이 중 두 번째 영역은 뇌 신경망 네트워크와 해부학적 특징을 고려하여 영역 간 연결성을 새로 정의하고 타우 슈퍼전파에 가장 유리한 연결성 구조를 가지는 허브 영역을 선택하였다. 제안된 두 아밀로이드-타우 상호작용의 시간적 순서와 시점을 결정할 수 있어 각 알츠하이머병 환자가 병 진행 과정에서 어느 단계에 있는지 알 수 있으며, 이는 해당 환자의 치료 전략을 세우는 데 큰 도움이 된다. 치료 방법의 부작용과 저렴하지 않은 비용 등을 고려하면 환자에게 해당 치료법이 효과가 있을지 가이드를 주는 것은 매우 중요한 문제이며, 환자뿐만 아니라 새로운 치료 약물을 개발하는 제약회사에서도 임상시험 시 적합한 약물 투여 대상자를 고르는 것은 해당 임상시험의 성공률을 높이는 가장 중요한 요소이다. 본 연구는 기존에 설명하지 못했던 타우 전파의 시작과 가속 두 현상의 기전을 각 현상에 알맞은 아밀로이드-타우 상호작용 모델을 도입하여 제시하고 이를 기준으로 환자들을 분류할 수 있다는 점에서 중요한 의미를 가지며, 환자의 치료 전략 결정, 임상시험 대상자 기준 제시, 예후 예측 등 다양한 의료 분야에서 도움을 줄 것으로 예상한다.
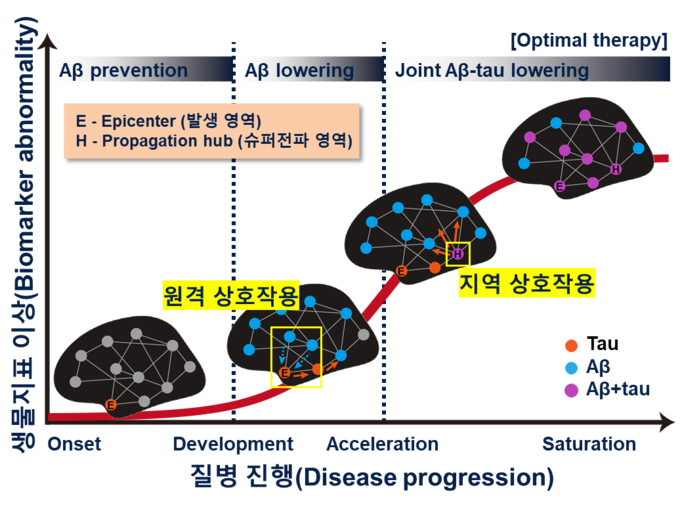
[ 그림 설명 ]
생물지표 이상(Y축)은 이상 단백질이 뇌에서 퍼진 정도를 나타내고, 질병 진행(X축)은 알츠하이머병의 진행 정도를 나타낸다.
결정적시기1 : 타우가 쌓이기 시작하는 발생 영역(epicenter)에서 멀리 떨어져 있는 영역의 아밀로이드와 원격 상호작용을 함으로써 처음 주변 영역으로 전파가 일어난다. 전파가 시작되기 전까지는 아밀로이드와 타우 모두 작용을 하지 않아 백신을 통한 예방 정도의 전략이 필요할 것으로 예상된다.
결정적시기2 : 타우가 주변 영역으로 퍼지다가 슈퍼전파 영역(propagation hub)에 도달하면 해당 영역에 이미 축적된 아밀로이드와 지역 상호작용을 거쳐 전파가 가속되어 슈퍼전파가 일어난다. 전파가 시작되고 슈퍼전파가 일어나는 시점까지는 타우보다는 아밀로이드의 영향력이 커서 아밀로이드를 중점적으로 치료하는 전략이 필요할 것으로 예상된다. 타우의 슈퍼전파가 일어나고 나면 타우가 빠른 시간 안에 광범위하게 퍼져 나가게 되므로 타우의 치료 없이 아밀로이드만 치료해서는 효과가 좋지 않을 것으로 예상된다.
연구진 소개
1. 이화진 박사(제1저자) 이력사항
1. 인적사항
● 소속: 고려대학교 바이오융합공학과
● E-mail: whajinlee3@gmail.com
2. 학력사항
● 2022년 고려대학교 바이오융합공학과 (박사)
● 2016년 고려대학교 바이오의공학부 (학사)
3. 경력사항
4. 전문분야 정보
● 뇌영상 분석, 인공지능 등
2. William B. Seeley 교수(공동교신저자) 이력사항
1. 인적사항
● 소속: Department of Neurology, Weill Institute for Neurosciences, University of California, San Francisco
● E-mail: bill.seeley@ucsf.edu
2. 학력사항
● 2019년 Diversity, Equity, and Inclusion Champion Training, University of California, San Francisco
● 1999년 School of Medicine, University of California, San Francisco (MD)
3. 경력사항
● 현재 Professor of Neurology, Weill Institute for Neurosciences, University of California, San Francisco
● 현재 Professor of Pathology, University of California, San Francisco
● 현재 Director of the UCSF Neurodegenerative Disease Brain Bank
● 2017년 Fellow, American Society for Clinical Investigation
● 2015년 Fellow, American Academy for the Advancement of Science
● 2011년 Fellow, MacArthur Foundation
● 2008년 Distinguished Scholar Award, Larry L. Hillblom Foundation
● 2003년 Resident Teacher of the Year, Neurology, Massachusetts General and Brigham and Women’s Hospitals
4. 전문분야 정보
● 신경병리학, 신경과학 등
3. 성준경 교수(교신저자) 이력사항
1. 인적사항
● 소속: 고려대학교 인공지능학과/바이오의공학부
● 전화: 02-3290-5660
● E-mail: jkseong@korea.ac.kr
2. 학력사항
● 2007년 Graphics and medical imaging technology, Universify of Utah (박사후과정)
● 2005년 서울대학교 컴퓨터공학부 (박사)
● 2000년 서울대학교 컴퓨터공학과 (학사)
3. 경력사항
● 2021-현재 고려대학교 보건과학대학 부학장
● 2019-현재 고려대학교 인공지능학과 (정교수)
● 2018-현재 고려대학교 바이오의공학부 (정교수)
● 2018-2019년 Visiting Scholar, Universify of California, San Francisco
● 2012-2018년 고려대학교 바이오의공학부 (조교수)
● 2010-2012년 숭실대학교 (조교수)
● 2008-2010년 KAIST (연구교수)
● 2008년 University of Utah (Research professor)
● 2007년 SIAM Young Research Support Program
● 2005년 National Scholarship
● 2003년 Microsoft Research Asia Fellowship 2003 Award
4. 전문분야 정보
● 뉴로이미징, 뇌공학, 인공지능 등